
Kandungan
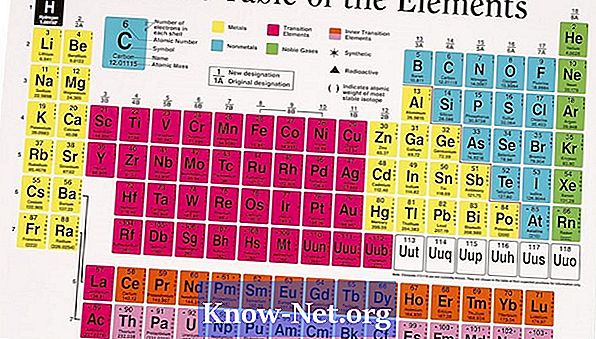
Kebanyakan unsur-unsur wujud dalam bentuk dalam bentuk lebih daripada satu isotop. Banyak isotop yang berlaku secara alami mempengaruhi jisim atom purata bagi elemen tersebut. Jisim atom yang terdapat di dalam jadual berkala ialah purata nilai-nilai isotop pelbagai yang mengambil kira kelimpahan masing-masing. Bagi unsur-unsur yang hanya mempunyai satu isotop, jisim atom adalah dekat dengan nilai jangkaan berdasarkan jumlah proton dan neutron dalam nukleus.
Arahan
-
Lihat isotop unsur yang menarik. Semua elemen mempunyai isotop minimum. Untuk mengira jisim atom purata, anda perlu tahu berapa banyak isotop yang ada, kelimpahannya dan jisim atomnya.
-
Cari kelimpahan semula jadi setiap isotop dan perhatikan nilai-nilai ini dengan nombor isotopik unsur tersebut.
-
Kirakan jisim atom menggunakan purata berwajaran. Melipatgandakan setiap isotop dengan banyaknya peratusan dan tambah semua nilai. Contohnya, magnesium mempunyai tiga isotop iaitu Mg (24), Mg (25) dan Mg (26), yang mana peratusnya adalah 78.9%, 10% dan 11.1% dan jumlahnya ialah 23.985, 24.986 dan 25.983, masing-masing. Purata berat dikira dari formula (peratusan 1 x jisim atom) + (peratusan 2 x jisim atom) + (peratusan 3 x jisim atom) = (0.789 x 23.985) + (0.1 x 24.986) + (0.111 x 25,983) = 18,924 + 2,499 + 2,884 = 24,307. Nilai yang diterbitkan ialah 24,305. Pembulatan nilai-nilai itu membenarkan perbezaan sedikit.
Apa yang anda perlukan
- Isotop unsur
- Kelebihan peratusan


